لیتیوم چیست و چه کاربردی دارد؟

لیتیوم چیست: لیتیوم فلز قلیایی با عدد اتمی ۳ است که در صنایع مختلف از جمله باتریسازی کاربرد دارد. چگالی لیتیوم از چگالی آب نیز کمتر است و فلز سبکی است. لیتیوم در دمای عادی اتاق حالت جامد دارد. در ادامه، با لیتیوم و کاربردها و ویژگیهای آن بیشتر آشنا میشویم. (لیتیوم را در فارسی گاهی لیتیم نیز مینویسند.)
لیتیوم چه کاربردی دارد؟
بعضی از کاربردهای مهم لیتیوم چنین است:
باتریهای یون لیتیوم
از لیتیوم در ساخت باتریهای قابل شارژ استفاده میشود زیرا سبکترین عنصر جامد دنیاست و اتمهای آن بهراحتی یک الکترون از دست میدهند تا بارشان مثبت شود. امروزه بسیاری از دستگاهها و تجهیزات الکترونیک با باتریهای قابلشارژ یون لیتیوم کار میکنند. مثلا خودروهای برقی، رایانهها و تلفنهای همراه و دوربینهای دیجیتال همگی از باتریهای یون لیتیوم نیرو میگیرند. حتی بعضی از باتریهای غیرقابلشارژ یا اصطلاحا یکبارمصرف در اسباببازیها و ساعتها نیز حاوی لیتیوم هستند.
آلیاژسازی
از ترکیب لیتیوم با بعضی از دیگر فلزها آلیاژهای مهمی تولید میشود. برای مثال، در اسکلت بدنه قطارهای پرسرعت و نیز در هواپیما و حتی دوچرخه از آلیاژ آلومینیوم-لیتیوم استفاده میشود، زیرا در عین سبکی، استحکام زیادی دارد. منیزیم-لیتیوم نیز آلیاژی است که بهسبب قدرت و استحکامش در ساخت زره خودروهای نظامی کاربرد دارد.
شیشه و سرامیک
لیتیوم چون دمای ذوب پایین و دوام و استحکام زیادی دارد، در صنعت شیشه و سرامیک بهکار میرود. لیتیوم بر سرعت ذوب شیشه میافزاید اما گرانرَوی و دمای پخت آن را کاهش میدهد. درنتیجه، کیفیت شیشه و قالبگیری آن بهبود مییابد و در عین حال، انرژی کمتری مصرف میشود. در سرامیکسازی نیز لیتیوم به کاهش دمای پخت کمک میکند، انبساط حرارتی را میکاهد و بر استحکام و کیفیت لعاب میافزاید. اکسید لیتیوم کیفیت و ظاهر شیشهها و سرامیکهای شفاف را ارتقا میدهد.
مواد نمگیر
مواد نمگیر، رطوبت محیط را جذب میکنند. یکی از نمگیرترین مواد، کلرید لیتیوم (LiCl) است که در خشککنها و سامانههای تهویه هوا به کار میرود. برای تصفیه هوا و حذف دیاکسید کربن در محیطهای بسته و کوچک مثل فضاپیماها و زیردریاییها از هیدروکسید لیتیوم و پروکسید لیتیوم استفاده میشود. همچنین در سامانههای تهویه هوا و خشککنهای صنعتی کلرید لیتیوم بهکار میبرند.
نگهداری هیدروژن
هیدروژن را میتوان بهشکل هیدرید لیتیوم (LiH) ذخیره کرد زیرا نگهداری آن آسانتر است.
سوخت جامد و سوخت موشک
از لیتیوم فلزی و هیدریدهای پیچیده آن در تولید سوخت جامد استفاده میشود و نیز یکی از افزودنیهای پرانرژی در پیشرانههای موشکی است.
مشعلهای علامتدهی
کوهنوردان، نظامیان و گروههای امداد و نجات برای علامت دادن به دیگران و مطلع کردن سایرین از محل استقرارشان از مشعلهای خاصی دارند که وقتی ضامن آن را میکشند، شعله و جرقههای سرخ درخشان تولید میکند. در قدیم برای تولید شعله سرخ از استرونتیوم استفاده میشد، اما تدریجاً ترکیبات نمکی لیتیوم جایگزین آن شد.
آتشبازی
مواد محترقه آتشبازی که در اعیاد و جشنها با آنها آسمان را نورباران میکنند، معمولا رنگهای مختلفی دارند. نور بعضی از آنها سبز، بعضی دیگر زرد یا حتی سفید و برخی دیگر قرمز است. در قدیم برای تولید نور قرمز در مواد محترقه آتشبازی از استرونتیوم استفاده میکردند اما چون استرونتیوم برای سلامت انسان مضر است، امروزه تدریجا ترکیبات لیتیوم بهکار میبرند، زیرا همانطور که گفتیم لیتیوم نیز وقتی میسوزد شعله قرمز درخشانی تولید میکند. ضمنا با کمی تغییر در ترکیبات لیتیوم میتوان شعلههایی به رنگ صورتی و نارنجی نیز تولید کرد.

چرا لیتیوم در صنعت باتریسازی مهم است؟
لیتیوم ظرفیت الکتروشیمیایی بسیار زیادی دارد، لذا عنصر بسیار مناسبی برای ساخت باتری یونی است. باتریهای یون لیتیوم در دستگاههای پیشرفته امروزی از جمله در خودروهای برقی، رایانهها و تلفنهای همراه بهکار میروند، زیرا چگالی انرژی زیادی دارند و بادوام هستند.
- لیتیوم نسبت به وزن خود (که بسیار کم است) انرژی زیادی در خود ذخیره میکند.
- بازده لیتیوم هنگام پر و خالی شدن باتری بسیار خوب است، لذا در باتریهای مخصوص تجهیزات سیار کاربرد زیادی دارد.
- پژوهشگران میکوشند با بهرهگیری از نوآوریهایی مثل طراحیهای حالت جامد، کارایی باتریهای لیتیومی را بیش از پیش افزایش دهند

کشف معدن لیتیوم در ایران
لیتیوم بهسبب کاربردهای گستردهاش در صنعت از جمله در حوزه ساخت باتری و آلیاژهای خاص، عنصری راهبردی و مهم است. در عین حال، لیتیوم عنصر کمیابی است و کشورهای کمی در دنیا معادن لیتیوم دارند. به لطف خدا، پژوهشگران کشورمان در سالهای اخیر ذخایر معدنی بزرگی از لیتیوم در کشورمان (همدان و کرمان) کشف کردند. با برنامهریزی درست و جلوگیری از خامفروشی میتوانیم جایگاه کشورمان را در صنایع مرتبط با لیتیوم در جهان ارتقا دهیم.
ویژگیهای لیتیوم چیست؟
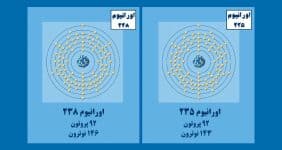
عدد اتمی لیتیوم ۳ است یعنی هر اتم لیتیوم در هسته خود ۳ پروتون دارد. لیتیوم فلزی نرم، آتشگیر و بسیار واکنشپذیر است و بهراحتی هیدروکسید تشکیل میدهد. جرم اتمی لیتیوم ۶.۹۴۱ گرم بر مول و در شرایط استاندارد، کمچگالترین فلز در بین همه فلزها است. چگالی لیتیوم حتی از چگالی آب نیز کمتر است و بههمین سبب روی آب شناور میماند. در ادامه، به خواص فیزیکی و شیمیایی لیتیوم اشاره میکنیم.
جدول: خواص فیزیکی لیتیوم چیست؟
| خواص فیزیکی | توضیح |
|---|---|
| حالت ماده در دمای اتاق | جامد |
| نرمی | بسیار نرم |
| رنگ | نقرهای مایل به سفید یا خاکستری |
| چگالی | کمچگالترین فلز؛ چگالی لیتیوم از چگالی آب کمتری است |
| سبکی | سبکترین فلز جامد |
| دستهبندی گروه | گروه ۱ (عناصر قلیایی) |
| عدد اتمی | ۳ |
| جرم اتمی | ۶.۹۴۱ گرم بر مول |
| دمای ذوب | ۱۸۰.۲ درجه سانتیگراد |
| دمای جوش | ۱۳۴۲ درجه سانتیگراد |
| گرمای خاص | ۳۵۸۲ ژول بر کیلوگرم.کلوین |
| رسانایی گرمایی | ۸۴.۸ وات بر ام.کا |

لیتیوم بهسبب واکنشپذیر بودنش، هم با مواد ارگانیک و هم غیرارگانیک واکنش میدهد و در گروه ۱ جدول تناوبی عناصر است؛ یعنی بهویژه وقتی با نافلزهایی مثل اکسیژن، هیدروژن، نیتروژن و هالوژنها مجاور باشد، بسیار واکنشپذیر است.
خواص شیمیایی لیتیوم چیست؟
بعضی از خواص شیمیایی لیتیوم چنین است:
- با هوا و آب خیلی زود واکنش میدهد.
- حالت اکسایش آن در ترکیبهای شیمیایی، ۱+ است زیرا فقط یک الکترون والانس دارد.
چند نمونه از واکنشهای شیمیایی لیتیوم:
واکنش لیتیوم با هوا: لیتیوم در مجاورت هوا (اکسیژن، O۲) میسوزد و شعله قرمز درخشان ایجاد میکند. مهمترین محصول چنین واکنشی مونوکسید لیتیوم (Li۲O) است.
4Li + O۲ -> 2Li۲O
واکنش لیتیوم با اسیدها: اکسید لیتیوم (LiO) و اسیدهایی مثل هیدروکلریک (HCI) با هم ترکیب میشوند و آب و کلرید لیتیوم (LiCl) تولید میکنند.
Li۲O -> 2LiCl + H۲O + 2HCl
واکنش لیتیوم با آب: اکید لیتیوم (Li۲O) و آب نیز با هم ترکیب میشوند و هیدروکسید لیتیوم (LiOH) و گاز هیدروژن تولید میکنند.
4LiOH + H۲ = 2Li۲O + 2H۲O
واکنش لیتیوم با نیتروژن: لیتیوم تنها فلز قلیایی است که مستقیما با نیتروژن (N۲) وارد واکنش میشود و آنگاه نیترید لیتیوم (Li۳N) تولید میشود.
6Li + N۲ -> 2Li۳N
واکنش لیتیوم با هیدروژن: لیتیوم سریعا با گاز هیدروژن (H۲) واکنش میدهد و محصول چنین واکنشی هیدرید لیتیوم است.
(LiH). 2Li + H۲ -> 2LiH
واکنش لیتیوم با کربن: وقتی لیتیوم با دیاکسید کربن (CO۲) وارد واکنش میشود، کربید لیتیوم و اکسید لیتیوم میسازد.
(Li2O).10Li + 2CO۲ -> Li۲C۲ + 4Li۲O
واکنش لیتیوم با هالوژنها: چون یون مثبت لیتیوم (Li+) کوچک است، لیتیوم با هالوژنها (یعنی فلور، کلر، بروم یا ید) واکنش میدهد و هالیدهای یونی میسازد. در معادله زیر X میتواند هرکدام از هالوژنهایی باشد که نام بردیم.
(LiX).2Li + X۲ -> 2LiX
رنگ لیتیوم و ترکیبات آن
رنگ لیتیوم طبیعی سفید مایل به خاکستری و فلز لیتیوم نقرهای یا خاکستری براق است، اما وقتی بسوزد شعله سرخ درخشانی منتشر میکند. همچنین لیتیوم را اگر به آب بیندازیم مثل سدیم میسوزد و شعله قرمز ایجاد میکند.

رنگ پودر کربنات لیتیوم سفید و ظاهرش شبیه نمک طعام است. کانیهای اصلی حاوی لیتیوم شامل اسپودومِن، پتالیت و لپیدولیت رنگهای مختلف از صورتی، سبز، بنفش و خاکستری زرد کمرنگ را در برمیگیرد. بعضی از کانیهای لیتیوم مثل تورمالین-روبلیت نیز ظاهری واقعا جذاب دارند.

کشف لیتیوم
لیتیوم را یوهان آگوست آرفویدسون در ۱۸۱۷ میلادی کشف کرد. لیتیوم فلزی نادر و فراوانی معدنی آن در پوسته زمین، ۰.۰۰۰۷ درصد است. ترکیبات لیتیوم از دیرباز در شیشهها و پروکلینهای مختلف به کار میرفته است. در سالیان اخیر لیتیوم بهجهت کاربردش در باتریهای سلولی خشک و راکتورهای هستهای اهمیت بیشتری یافته است.
لیتیوم چگونه نگهداری میشود؟
لیتیوم را باید در محیطهای غیرواکنشی نگه داشت، زیرا همانطور که گفتیم بسیار واکنشپذیر است و برای مثال، با هوای عادی نیز بسیار زود وارد واکنش میشود و خلوص خود را از دست میدهد. مثلا، لیتیوم را میتوان زیر روغن یا در اتمسفر داخلی (اینرت) نگه داشت تا با هوا یا رطوبت موجود در هوا ترکیب نشود.
جمعبندی: لیتیوم چیست و چه کاربردهایی دارد
توضیح دادیم که لیتیوم چیست و چه کاربردهایی دارد و با خواص فیزیکی و شیمیایی آن آشنا شدیم. گفتیم که لیتیوم بهسبب کاربردش در باتریهای قابل شارژ یون لیتیوم، در صنعت خودروهای برقی و دوگانهسوز (برقی و سوخت فسیلی) و نیز در صنعت رایانه و الکترونیک اهمیت زیادی دارد. همچنین دانستیم که طی سالهای اخیر ذخایر بزرگ لیتیوم در کشورمان کشف شده است و با برنامهریزی درست و جلوگیری از خامفروشی میتوانیم جایگاه کشورمان را در صنایع مرتبط با لیتیوم در جهان ارتقا دهیم.